急性淋巴细胞白血病(ALL)作为一种高度异质性的血液系统恶性肿瘤,主要特征为骨髓、外周血和其他器官中大量未成熟淋巴细胞的异常增殖和浸润,其治疗始终是医学界面临的严峻挑战。近年来,CAR-T治疗作为一种创新的细胞免疫治疗手段,为ALL的治疗开辟了新途径。《医师报》特邀陆军军医大学第二附属医院血液科张诚教授分享ALL细胞免疫治疗的应用与前景。
追根溯源,基因突变为ALL重要发病机制
ALL是一种早期分化受阻的淋巴细胞恶性增殖性疾病,主要分为B淋巴细胞白血病(B-ALL)及T淋巴细胞白血病(T-ALL)2种类型。其病理表现原始及早幼淋巴细胞的异常增殖和聚集,发病机制涉及多种外界致病因素(包括病毒感染、长期接触电离辐射、有毒化学物质等)引发内在基因变化,导致特定蛋白质功能异常和淋巴细胞的恶性增殖,并可能侵及骨髓外组织,如脑膜、淋巴结、性腺、肝等,导致相应的组织损伤和功能障碍[1]。
ALL具有高度异质性,其诊疗需综合形态学、免疫学、细胞遗传学和分子生物学评估。随着对ALL发病机制的深入研究,基因突变在发病、分型及预后中的作用日益凸显[2]。2023 CSCO指南[3]建议ALL患者接受全面的细胞遗传学分析,包括染色体核型分析及必要的荧光原位杂交(FISH)检查,并开展分子检测如融合基因筛查,以实现精准预后分层和个性化治疗。同时,微小残留病灶(MRD)检测作为ALL疗效评价的重要环节,也得到越来越多的关注。2023ELN指南[4]强调应在诊断时建立MRD检测,治疗过程中动态跟踪治疗效果,协助优化后续治疗方案。
突破创新,CAR-T治疗进展飞速
在新药时代到来之前,ALL的治疗主要依赖于诱导化疗与后续的异基因造血干细胞移植(allo-HSCT),尽管诱导化疗能使80%~90%的患者病情得到缓解,但复发风险仍较高[5]。对于复发或难治性(R/R)ALL患者而言,传统治疗手段如化疗和供者淋巴细胞输注(DLI)往往效果有限,预后不容乐观。
随着医学研究的深入,ALL治疗领域取得了显著进展。CAR-T细胞治疗作为一种新兴的治疗方式,为R/R ALL患者带来了新的希望。CAR-T细胞与肿瘤抗原结合,不仅激发其细胞毒性作用,而且可促进CAR-T细胞在体内增殖,延长CAR-T细胞存活。研究显示CAR-T细胞治疗成人或儿童R/R ALL的完全缓解(CR)率为62%~95%,展现了广阔的治疗前景。尽管不同临床试验中的CAR-T细胞制备过程中包含的CD28或41BB共刺激分子、制作工序各异,入组人群不尽相同,但患者从接受CAR-T细胞回输到获得CR的中位时间平均为1个月左右,且CR率不受基因突变类型、数量以及前线治疗的影响。50%~80%接受CAR-T细胞治疗并获得CR的R/R ALL患者可达到MRD阴性[5],提示CAR-T治疗能够给患者带来深度的疾病缓解,展现出了巨大的治疗潜力。
本团队的一项回顾性研究证实,供者来源的CD19 CAR-T细胞在治疗B-ALL移植后复发方面具有显著的疗效和良好的安全性(图1)[6]。这一发现为ALL患者提供了新的治疗策略,有望改善患者的生存预后,为未来的治疗开辟新的道路。
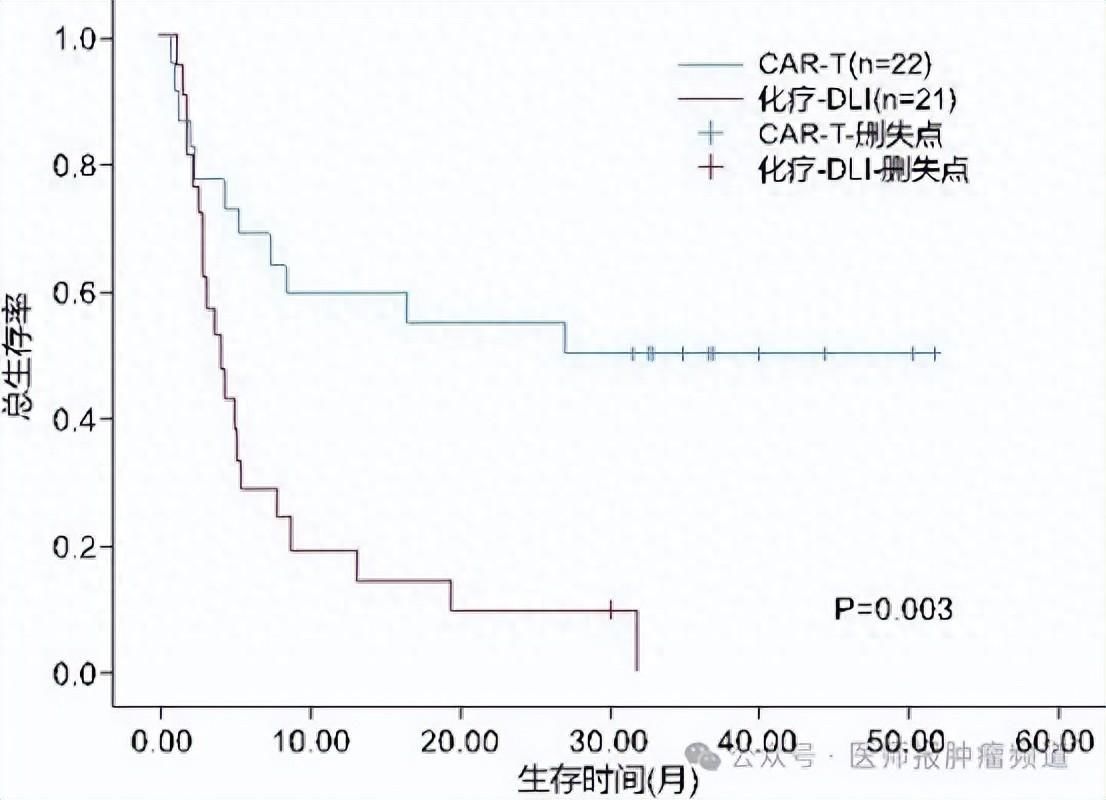
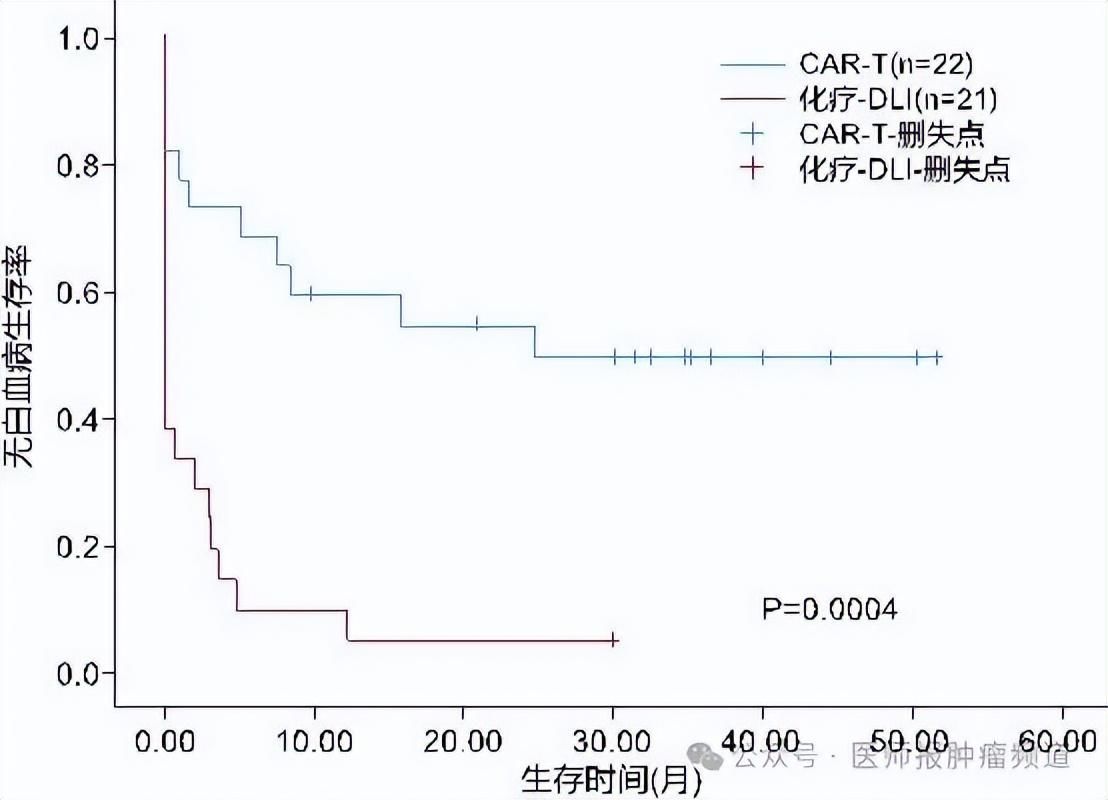
图1 CAR-T细胞和化疗联合DLI治疗同种异体移植后复发性B-ALL患者的生存曲线[6]
道阻且长,CAR-T细胞治疗仍面临诸多挑战
目前,CAR-T细胞治疗在临床实践中仍面临诸多挑战。CAR-T细胞治疗的不良反应发生率约为95%,虽然大部分不良反应是自限性的,但部分不良反应可危及生命。最常见的并发症是细胞因子释放综合征(CRS)、神经毒性和B细胞再生障碍,仍需临床重点关注[7]。
此外,CAR-T细胞制备时间长、工艺复杂且持久性差,患者可能在等待期间白血病细胞迅速增殖,导致部分患者因等待过长而错失治疗良机,这已成为临床实践中的棘手问题。为解决这一难题,本团队牵头的一项多中心研究提出了FAST CAR-T细胞治疗的新思路,其制备仅需1天,显著缩短临床等待时间且临床疗效显著。研究中18例可评价的患者28天全部达到完全缓解,缓解率高达100%,MRD阴性的患者比例为94.4%。三个月后缓解率仍高达83.3%,MRD阴性的患者比例为77.8%(图2)[8]。然而,CAR-T细胞体内续存时间和杀伤能力尚不明确,且有效剂量和不良反应发生的危险因素也有待进一步探索。因此,扩大CAR-T的临床应用仍是长期且艰巨的任务,需要未来深入研究,不断优化治疗方案,以提高患者的缓解率和长期生存率。
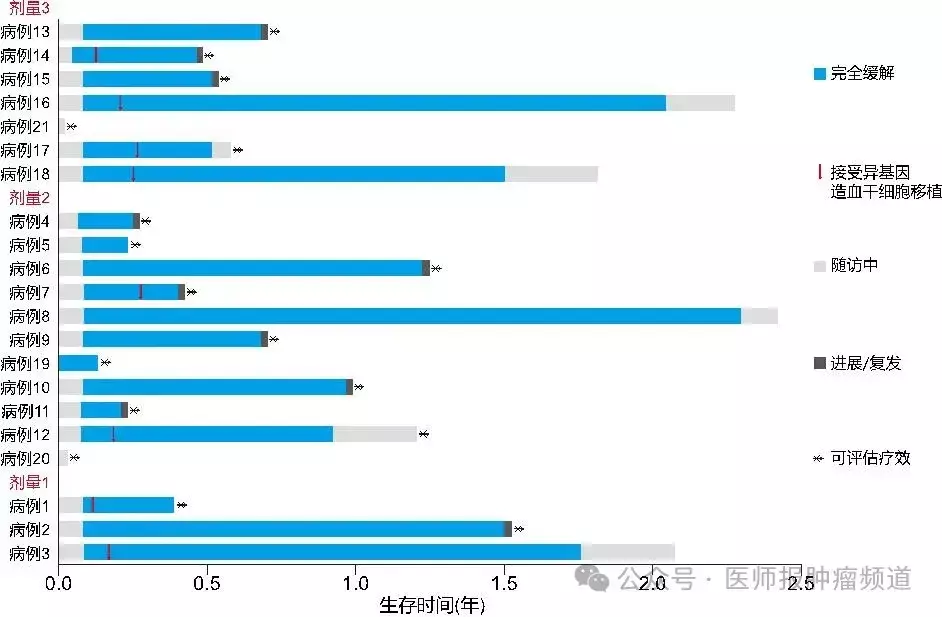
图2 入组临床研究的R/R B-ALL患者在FAST CAR-T细胞治疗后的生存期[8]
张诚教授总结:
ALL作为血液系统恶性肿瘤,难治复发是其预后差的主要因素。近年来,CAR-T细胞治疗为ALL患者带来了新希望,然而不良反应的频发和细胞制备的优化等问题依然有待解决。未来仍需深入研究CAR-T细胞构建和治疗方案的优化,进一步提高患者的长期生存。
张诚教授简介

陆军军医大学新桥医院血液病医学中心 副主任
白血病科 主任
主任医师 教授 博士研究生导师
重庆英才——创新领军人才
全国抗击新冠疫情先进个人
重庆金口碑医生
陆军军医大学首届医疗红医名师
陆军军医大学优秀研究生导师
国家自然科学基金评审专家
新桥医院首届杰出青年医师
获军队优秀人才岗位津贴
中华医学会血液学专委会第11届感染学组委员
中国抗癌协会血液肿瘤专委会淋巴肿瘤学组委员
重庆市中西医结合细胞治疗专委会副主任委员
重庆市医学会血液学分会委员及白血病组组长
重庆市医师协会血液学分会常务委员
重庆市劳动能力鉴定医疗卫生专家
重庆市血液内科医疗质量控制中心秘书
主要从事白血病与细胞免疫治疗的基础与临床研究。获计算机软件著作权、国家发明和实用新型专利共23项,主持军队重大课题分课题、国自然面上等10余项课题,以第一或通讯作者在Blood、leukemia、JHO等发表SCI论文50余篇,获国家科技进步二等奖1项、中华医学科技奖一等奖1项、重庆市科技进步一等奖2项、二等奖1项,获军队医疗成果二等奖3项,中国抗癌协会科技奖三等奖1项,校教学成果三等奖。副主编《医话血液》获全国优秀科普作品,《Blood》中文版细胞治疗与免疫治疗编委,《Biomaterial》、《JHO》《CMJ》等编委及审稿专家
参考文献:
[1] Brown P A, Shah B, Advani A, et al. Acute Lymphoblastic Leukemia, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2021,19(9):1079-1109.
[2] Duncavage E J, Bagg A, Hasserjian R P, et al. Genomic profiling for clinical decision making in myeloid neoplasms and acute leukemia[J]. Blood, 2022,140(21):2228-2247.
[3] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)恶性血液病诊疗指南2023[M].北京:人民卫生出版社, 2023.
[4] Gokbuget N, Boissel N, Chiaretti S, et al. Diagnosis, Prognostic Factors and Assessment of ALL in Adults: 2023 ELN Recommendations from a European Expert Panel[J]. Blood, 2024.
[5] 常英军,赵翔宇,嵌合抗原受体-T细胞免疫治疗难治/复发急性淋巴细胞白血病的挑战与对策.中华检验医学杂志,2022,45(08) : 777-782.
[6] Tan X, Wang X Q, Zhang C, et al. Donor-derived CD19 CAR-T Cells versus Chemotherapy Plus Donor Lymphocyte Infusion for Treatment of Recurrent CD19-positive B-ALL After Allogeneic Hematopoietic Stem Cell Transplantation[J]. Curr Med Sci, 2023,43(4):733-740.
[7] Zhang C, Wang X Q, Zhang R L, et al. Donor-derived CD19 CAR-T cell therapy of relapse of CD19-positive B-ALL post allotransplant[J]. Leukemia, 2021,35(6):1563-1570.
[8] Zhang C, He J, Liu L, et al. Novel CD19 chimeric antigen receptor T cells manufactured next-day for acute lymphoblastic leukemia[J]. Blood Cancer J, 2022,12(6):96.
友情提示
本站部分转载文章,皆来自互联网,仅供参考及分享,并不用于任何商业用途;版权归原作者所有,如涉及作品内容、版权和其他问题,请与本网联系,我们将在第一时间删除内容!
联系邮箱:1042463605@qq.com